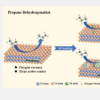
纽约大学生物医学工程系陈教授领导的一项新研究发现了机械约束在胶质母细胞瘤中的作用。本研究探讨了 GBM 中 C 的机械约束介导的出现和空间模式所涉及的潜在机械传导机制。他们利用二维微图案化多细胞模型,揭示了 Piezo1 与粘着斑、钙粘蛋白和下游细胞骨架机制合作,调节癌细胞的机械感应以适应 GBM 肿瘤微环境中的机械约束,并指导 C 的空间图案。

胶质母细胞瘤(GBM)是起源于神经胶质细胞的最具侵袭性的脑肿瘤类型。其特点是肿瘤微环境中大部分癌细胞具有干细胞样特性。这种癌细胞亚群被称为“癌症干细胞”(C),由其自我更新和肿瘤启动能力定义。 C与肿瘤发生、转移、对癌症治疗的高耐药性以及患者的低生存率密切相关。尽管其预后意义重大,但 GBM 中 C 的起源尚未完全清楚。 C的出现可能源于内在和外在因素。
GBM 的一个主要机械特征是由于刚性颅骨对肿瘤的物理限制而导致肿瘤内部累积的应力。在这种情况下,过度拥挤的肿瘤微环境中的 GBM 细胞会受到影响细胞体和细胞核的机械约束,导致细胞变形、牵引力和癌细胞 DNA 转录等许多细胞改变。此外,受限肿瘤微环境内产生的机械应力梯度可以机械地诱导不同区域癌细胞的恶性表型,并影响肿瘤内C的出现和空间分布。最近的研究发现,无论体外还是体内,肿瘤干细胞在肿瘤组织中的分布并不均匀。例如,EMT 和 C 优先发生在单层细胞的外围区域。尽管大量证据支持肿瘤微环境中的这些机械线索影响 C 表型和力学,但仍不清楚由于肿瘤机械约束而导致的细胞内和细胞间力的协作如何调节 GBM 中 C 的出现和空间模式。更重要的是,人们对引发 C 出现并维持 GBM 肿瘤中 C 空间异质性的潜在机械敏感信号知之甚少。
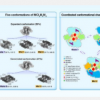
在这项研究中,Chen 的实验室使用二维 (2D) 微图案多细胞模型来检查肿瘤中的机械约束对 GBM 中 C 的出现和空间图案的影响。他们专门研究了细胞-ECM 和细胞-细胞相互作用产生的力之间的相互作用如何引导 GBM 中 C 的出现和空间分布。在不同的几何多细胞模式中,周围区域的 GBM 细胞均表达较高水平的 C 标记。研究发现,C 的独特空间模式与受限环境中产生的机械应力梯度相对应。他们进一步强调了Piezo1机械敏感通道、整合素和钙粘蛋白在调节GBM细胞机械传感方面的协调作用,并证明Piezo1的上调在GBM细胞向C的表型转换中发挥着关键作用。这些发现强调了源自细胞收缩性和细胞间相互作用的机械力在确定 GBM 中 C 的独特空间模式中的作用,这些机械力是由多细胞组织中的机械约束产生的。